核准日期: 2013年09月10日
修改日期: 2014年03月19日
2014年04月23日 莎普爱思®
2014年08月05日
2015年01月26日
2015年02月15日
2015年12月25日
2016年05月09日
2020年08月01日
头孢克肟分散片说明书
请仔细阅读说明书并在药师指导下使用
浙江莎普爱思药业股份有限公司 50mg
【药品名称】
通用名称:头孢克肟分散片
英文名称:Cefixime Dispersible Tablets
汉语拼音:Toubaokewo Fensanpian
【成 份】
化学名称:(6R, 7R)-7-〔〔(Z)-2-(2-氨基-4-噻唑基)-2-〔(羧甲氧基)亚氨基〕乙酰基〕氨 基〕-3-乙烯基-8-氧代-5-硫杂-1-氮杂双环[4. 2. 0]辛-2-烯-2-羧酸三水合物。
化学结构式: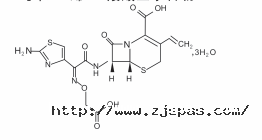
分子式:C16H15N507S2 ・ 3H2O
分子量:507.50
【性 状】本品为类白色片。
【适 应 症】
本品适用于对头孢克肟敏感的链球菌属(肠球菌除外)、肺炎球菌、淋球菌、卡他布兰汉球菌、 大肠杆菌、克雷伯杆菌属、沙雷菌属、变形杆菌属及流感杆菌等引起的下列细菌感染性疾病:
1.支气管炎、支气管扩张症(感染时),慢性呼吸系统感染疾病的继发感染,肺炎;
2.肾盂肾炎、膀胱炎、淋球菌性尿道炎;
3.胆囊炎、胆管炎;
4.猩红热;
5.中耳炎、副鼻窦炎。
【规 格】50mg (按头孢克肟计算)
【用法用量】
用法:加水分散后口服,或含于口中吮服或吞服。
成人及体重30公斤以上儿童用量:口服,一次100mg (2片),一日二次;成人重症感染者,可增加至一次200mg (4片),一日二次。
儿童:口服,按一次每公斤1. 5〜3. 0mg计算给药量,一日二次。或遵医嘱。
【不良反应】
在总病例12, 879例中,发现包括临床检查值异常在内共294例(2.58%)的不良反应。这些不良反 应包括腹泻等消化道症状112例(0.87%),皮疹等皮肤症状29例(0.23%),另外,临床检查值异常包括ALT升高78例(0.61%) , AST升高58例(0.45%),嗜酸细胞増多26例(0. 20%)。
(1 )严重不良反应:
①休克:由于引起休克(<0. 1%)的可能性,应密切观察,如有出现不适感,口内异常感、哮喘、 眩晕、便意、耳鸣、出汗等现象,应停止给药,采取适当处置;
②过敏样症状:有出现过敏样症状(包括呼吸困难、全身潮红、血管性水肿、荨麻疹等)(<0. 1%)的可能性,应密切观察,如有异常发生时停止给药,采取适当处置;
③皮肤病变:有发生皮肤粘膜眼症候群(Stevens-Johnson症候群,<0. 1%),中毒性表皮坏死症 (Lyell症候群,<0.1%)的可能性,应密切观察,如有发生发热、头痛、关节痛、皮肤或粘膜红斑、水 泡、皮肤紧张感、灼热感、疼痛等症状,应停止给药,采取适当处置;
④血液障碍:有发生粒细胞缺乏症(<0. 1%,早期症状:发热、咽喉疼、头疼、惓怠感等),溶血 性贫血(<0. 1%,早期症状:发热、血红蛋白尿、贫血等症状),血小板减少(<0. 1%,早期症状: 点状出血、紫斑等)的可能性,且有其他头孢类抗生素造成全血细胞减少的报告,因此应密切观察,例如进行定期检查等,有异常发生时应停止给药,采取适当处置;
⑤肾功能障碍:由于引起急性肾功能不全等严重肾功能障碍(<0. 1%)的可能性,因此应密切观 察,例如进行定期检查等,如有异常发生时,应停止给药,采取适当处置;
⑥结肠炎:可能引起伴有血便的严重大肠炎,例如伪膜性结肠炎等(<0. 1%)。如有腹痛、反复腹泻出现时,应立即停止给药,采取适当处置;
⑦间质性肺炎:PIE症候群:有出现伴有发热、咳嗽、呼吸困难、胸部X线异常,嗜酸细胞增多等症状的间质性肺炎,PIE症候群(分别<0.1%)等的可能性,如有上述症状发生应停止给药,采取给予 糖皮质激素等适当处置;
(2)其它不良反应:不良反应发生率在0. 1〜5%为常见,在0.1%以下为少见。
过敏:常见皮疹、荨麻疹、红斑,少见瘙痒、发热、浮肿;
血液:常见(0.1〜5%)嗜酸细胞增多,少见粒细胞减少;
肝脏:常见血清谷丙转氨酶(ALT)升高,血清谷草转氨酶(AST)升高、少见黄疸;
肾脏:少见尿素氮(BUN)升高;
消化系统:常见有腹泻、胃部不适,少见恶心、呕吐,腹痛、胸部烧灼感、食欲不振、腹部饱满 感、便秘;
菌群失调症:少见口腔炎、口腔念球菌症;
维生素缺乏症:少见维生素K缺乏症(低凝血酶原血症,出血倾向等),维生素B缺乏症(舌炎、口腔 炎、食欲不振、神经炎等);
其它:头痛、头晕。
【禁 忌】对本品或其他头孢类抗生素过敏者。
【注意事项】
1.为防止耐药菌株的出现,在使用本品前原则上应确认敏感性,将剂量控制在控制疾病所需最小剂量。
2.对于严重肾功能障碍患者,由于药物在血液中可维持浓度,因此应根据肾功能状况适当减量,给药 间隔应适当增大。
3.下列患者慎重给药:
①对青霉素类有过敏史的患者。
②本人或父母、兄弟中,具有易引起支气哮喘、皮疹、荨麻疹等过敏症状体质的患者。
③严重的肾功能障碍患者。
④经口给困难或非经口营养患者,全身恶液质状态患者。(因时有出现维生素K缺乏症状,应注意观察。)
4.由于有可能出现休克,给药前应充分询问病史。
5.不要将牛奶、果汁等与药混合后放置。
6.对临床检验结果的影响:
①除试纸反应以外,对斑氏(Benedict)试剂、亚铁(Fehling)试剂、尿糖试药丸(Clinitest)进行尿糖检查,有假阳性出现的可能性,应予以注意。
②有出现直接库姆斯试验阳性的可能性,应予以注意。
7.严禁用于食品和饲料加工。
【孕妇及哺乳期妇女用药】
妊娠期妇女使用本品的安全性和有效性尚未确立,仅在确实需要使用时使用本品;尚不清楚本品是否从乳汁中分泌,必需使用时应暂停哺乳。
【儿童用药】对于早产儿、新生儿用药的安全性尚未确立(没有使用经验)。
【老年用药】老年患者用药酌减。
【药物相互作用】
卡马西平:与本品合用时可引起卡马西平水平升高,必须合用时应监测血浆中卡马西平浓度。
华法令和抗凝药物:与本品合用时增加凝血酶原时间。
【药物过量】洗胃,无特殊解毒药物,血液透析和腹膜透析不能有效将本品清除。
【药理毒理】
药理作用
本品为口服第三代头孢菌素,抗菌谱广,对部分革兰氏阳性菌及阴性菌均具有抗菌活性,特别是对革兰氏阳性菌中的链球菌(肠球菌除外)、肺炎球菌,革兰氏阴性菌中的淋球菌、布兰汉氏球菌、大肠菌、克雷伯氏属、沙雷氏属、变形杆菌属、流感杆菌等有较强的抗菌作用,其作用机制为阻止细菌细胞 壁的合成,其作用特点因细菌的种类而异,与青霉素结合蛋白(PBP)中PBP1 (1a, 1b, 1c)以及PBP3有 较高亲和性。本品对各种细菌产生的β-内酰胺酶具有较强的稳定性。
毒理研究
生殖毒性:SD大鼠在妊娠前和妊娠初期口服给药100~1000mg/kg,在器官形成期、围产期、哺乳期口服给药320〜3200mg/kg,对大鼠生育力未见影响,未出现致畸作用,新生幼鼠的生长、发育和生殖能力也未发现异常。
【药代动力学】
据PDR57版:头孢克肟口服后,其绝对生物利用度为40〜50%,不受饮食影响。头孢克肟片剂200mg单剂口服,血浆峰浓度为3. 7ug/ml,等剂量口服头孢克肟混悬液产生的峰浓度比片剂高出25%〜50%。头孢 克肟200mg混悬液和400mg混悬液产生的平均峰浓度为3ug/ml和4. 6ug/ml, 口服头孢克肟混悬液100mg至 400mg,时间-浓度曲线下面积比口服等剂量片剂高出10%~25%,混悬液剂型替换片剂剂型应考虑到其增加的吸收量。单剂口服200mg片剂、400mg片剂、400mg混悬液的达峰时间为2~6小时,单剂口服200mg混 悬液的达峰时间为2~5小时。24小时内吸收药物的50%以原形从尿中排出。血清蛋白结合率为65%,连续 服药14天,未发现头孢克肟在体内有蓄积作用。头孢克肟血浆半衰期为3~4小时,但在一些志愿者可达 9小时,与剂型无关。
特殊人群药代动力学
老年患者:稳态时平均AUCs比正常成人约有40%的升高。
肾功能不全受试者:肌酐清除率为20~50ml/min时,头孢克肟平均血清半衰期延长至6. 4小时;肌酐清除率为5~20ml/mi n时,头孢克肟平均血清半衰期延长至11. 5小时。
血液透析和腹膜透析:头孢克肟不能有效地从血中清除。但也有文献提示,血液透析的患者,服 用400mg剂量头孢克肟,其血中变化情况和肌酐清除率水平为21-60ml/mi n的受试者相似。
【贮 藏】遮光,密封,在阴凉(不超过20°C)处保存。
【包 装】铝塑铝包装,6片×1板/盒;10片×1板/盒;12片×1板/盒;18片×1板/盒;12片×2板/盒。
【有 效 期】24个月。
【执行标准】《中国药典》2010年版第三增补本,性状、有关物质执行YBH03262013
【批准文号】国药准字H20133261
【生产企业】
药品上市许可持有人:浙江莎普爱思药业股份有限公司
注册地址:浙江省平湖市经济开发区新明路1588号
邮政编码:314200
电话号码:0573-85013690、0573-85025749
传真号码:0573-85229378、0573-85229396
网 址:http://www.zjspas.com
药品生产企业:浙江莎普爱思药业股份有限公司
生产地址:浙江省平湖市经济开发区新明路1588号